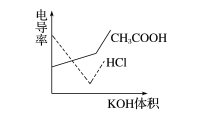
电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。下图是KOH溶液分别滴定HCl溶液和CH3COOH溶液的滴定曲线示意图。下列示意图中,能正确表示用NH3·H2O溶液滴定HCl和CH3COOH混合溶液的滴定曲线的是( )
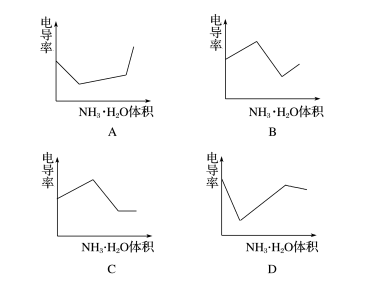
答案 D
解析 HCl为强电解质,CH3COOH为弱电解质,滴加NH3·H2O,先与HCl反应,生成同样为强电解质的NH4Cl,但溶液体积不断增大,溶液稀释,所以电导率下降。当HCl被中和完后,继续与CH3COOH弱电解质反应生成CH3COONH4,为强电解质,所以电导率增大。HCl与CH3COOH均反应完后,继续滴加弱电解质NH3·H2O,电导率变化不大,因为溶液被稀释,有下降趋势。