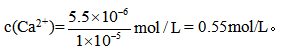某研究小组利用海水提取粗盐后得到的苦卤(含Mg2+、Ca2+、Br-等离子的溶液)提取Br2并制备含镁化合物。部分工艺流程设计如下:
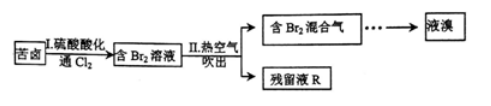
回答下列问题:
(1)步骤I中用硫酸酸化可抑制氯气与水的反应,原因是 (结合离子方程式回答)。
(2)工业上常用Na2CO3法或SO2法实现含Br2混合气到液溴的转化,流程如下:
Na2CO3法:
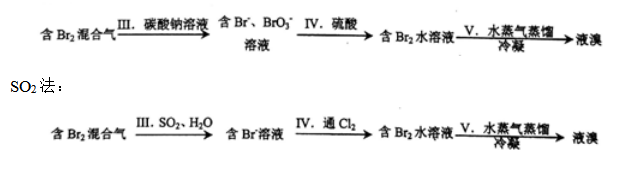
① Na2CO3法中步骤Ⅲ的反应有气体生成,离子方程式为 。步骤V中蒸馏时蒸气出口温度通常控制在65-75℃,若温度过低,溴蒸出不充分;若温度过高,则会导致液溴中混有较多的 。
② SO2法对比Na2CO3法的缺点是 (答出一条即可)。
(3)提溴后所得含Mg2+、Ca2+的溶液可设计如下流程制备碱式碳酸镁[Mg5(OH)2(CO3)4·4H2O]和无水氯化镁:
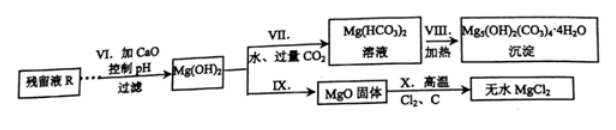
① 步骤Ⅷ的化学方程式为 。
② 若步骤X中生成的CO与CO2物质的量之比为3:1,写出反应的化学方程式 。
③25℃,步骤Ⅵ生成Mg(OH)2沉淀后,若溶液中残留的Mg2+浓度为l.8×10-6mol/L 。则溶液的pH为 ;此pH下,欲使Mg(OH)2沉淀中不含Ca(OH)2,则溶液中c(Ca2+)不能大于 (已知:25℃时,Ksp[Mg(OH)2]=1.8×10-11,Ksp[Ca(OH)2]=5.5×10-6)
溶液c(H+)增大,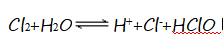 的平衡逆移,从而抑制氯气与水的反应 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 水 SO2和Cl2有毒, 可能导致环境污染
的平衡逆移,从而抑制氯气与水的反应 3CO32-+3Br2=5Br-+BrO3-+3CO2↑ 水 SO2和Cl2有毒, 可能导致环境污染 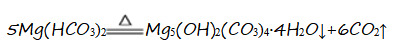
 11.5 0.55mol/L
11.5 0.55mol/L
【详解】 ,当溶液c(H+)增大,平衡逆移,从而抑制氯气与水的反应,故步骤I中用硫酸酸化时大致抑制氯气与水的反应的目的;
,当溶液c(H+)增大,平衡逆移,从而抑制氯气与水的反应,故步骤I中用硫酸酸化时大致抑制氯气与水的反应的目的;
(2)①用Na2CO3溶液吸收含Br2的混合气体,生成Br-、BrO3-的同时,反应有CO2气体生成,根据电子守恒、电荷守恒及原子守恒得此反应的离子方程式为3CO32-+3Br2=5Br-+BrO3-+3CO2↑;溴易挥发,含溴的水溶液中通蒸气可促进溴蒸发,但温度过高,水也易蒸发出,导致液溴中仍混有一定量的水;
②对比Na2CO3法 ,SO2法使用的SO2和Cl2有毒,可能导致环境污染;
(3)① 步骤Ⅷ将Mg(HCO3)2溶液加热得到碱式碳酸镁[Mg5(OH)2(CO3)4·4H2O],结合原子守恒,发生反应的化学方程式为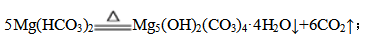
② 步骤X高温加热MgO、Cl2及C的混合物,生成的CO与CO2物质的量之比为3:1,同时得到MgCl2,反应中氯气是氧化剂,碳是还原剂,根据电子守恒及原子守恒可得此反应的化学方程式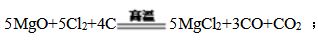
③已知:25℃时,Ksp[Mg(OH)2]=c(Mg2+)×c2(OH-)=1.8×10-11,则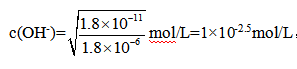 ,此时溶液的pH为14-2.5=11.5;Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,
,此时溶液的pH为14-2.5=11.5;Ksp[Ca(OH)2]=c(Ca2+)×c2(OH-)=5.5×10-6,