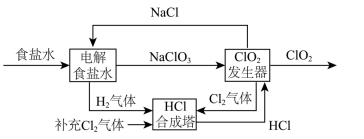
1.为抑制新冠病毒传播,含氯消毒剂被广泛使用。常见的含氯消毒剂有次氯酸盐、ClO2、有机氯化物等。用NaCl电解法生成ClO2的工艺原理示意图如图,发生器内电解生成ClO2。
完成下列填空:
(1)Cl原子的最外层电子层上具有 种不同能量的电子;HClO的电子式是 ;
(2)Cl2性质活泼,易形成多种化合物。请说明NaCl的熔沸点比HCl高的原因:
(3)根据示意图,补充并配平ClO2发生器中发生的化学反应方程式: 。
_____NaClO3+_____HCl =_____+_____H2O
若反应中有2mol电子发生转移,则生成ClO2 mol。
(4)某兴趣小组通过实验测定不同pH环境中,相同浓度NaClO溶液的细菌杀灭率(%),实验结果如下表。
NaClO溶液浓度/ (mg·L-1) | 不同pH下的细菌杀灭率/% | ||
pH=4.0 | pH=6.5 | pH=9.0 | |
250 | 98.90 | 77.90 | 53.90 |
①NaClO溶液呈碱性的原因是 (用离子方程式表示)。
②调节NaClO溶液pH时不能选用盐酸的原因为 。
③由表中数据可推断,该实验得到的结论是
④家用消毒常用84消毒液而不采用次氯酸,说明其理由。
2.铝氢化钠(NaAlH4)是有机合成的重要还原剂,其合成路线如下:
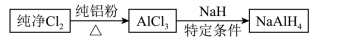
(1)已知AlCl3的熔点为190℃,沸点为178℃,在潮湿的空气中易水解。某实验小组利用下图中装置制备无水AlCl3(夹持装置略去)。
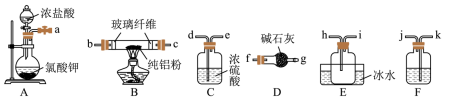
①圆底烧瓶中发生反应的化学方程式为 。
②按气流方向连接各仪器接口,顺序为a→ →b→c→h→i→f→g(填接口字母)。
③装置A盛放浓盐酸的仪器名称为 ,装置F中应盛放的试剂是 ,装置D的作用是 。
(2)AlCl3与NaH反应时,需先将AlCl3溶于有机溶剂,再将得到的溶液滴加到NaH粉末中,此反应中NaH的转化率较低,其原因可能是 。
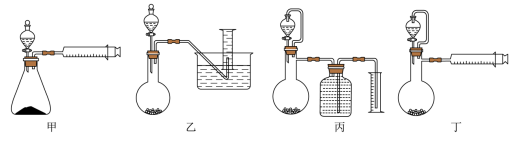
(3)通过测定铝氢化钠与水反应生成氢气的体积来测定铝氢化钠样品的纯度。
①铝氢化钠与水反应的化学方程式为 。
②设计如下四种装置(夹持装置略去)测定铝氢化钠样品的纯度(杂质只有氢化钠)。从简约性、准确性考虑,最恰当的装置是 (填编号)。
答案:
1.(1) 2 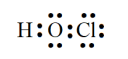
(2)NaCl是离子晶体,而HCl是分子晶体
(3) 5NaClO3+6HCl =6ClO2↑+5NaCl+3H2O 2.4
(4) 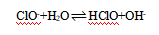 NaClO+2HCl=NaCl+Cl2↑+H2O产生有毒气体Cl2污染环境 等浓度的NaClO溶液pH越大,细菌杀灭率越小 HClO见光易分解,不易保存,而次氯酸钠性质较稳定则易保存
NaClO+2HCl=NaCl+Cl2↑+H2O产生有毒气体Cl2污染环境 等浓度的NaClO溶液pH越大,细菌杀灭率越小 HClO见光易分解,不易保存,而次氯酸钠性质较稳定则易保存
【详解】(1)已知Cl是17号元素,则Cl原子的最外层电子排布式为:3s23p5,故Cl原子的最外层电子层上具有2种不同能量的电子,H、Cl原子能形成1对共用电子对,O需形成2对共用电子对,HClO的电子式是 ,故答案为:2;
,故答案为:2;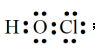 ;
;
(2)由于NaCl是离子化合物,形成离子晶体,而HCl为共价化合物,形成分子晶体,故NaCl的熔沸点比HCl高,故答案为:NaCl是离子晶体,而HCl是分子晶体;
(3)根据示意图,ClO2发生器中发生NaClO3和HCl反应生成NaCl和ClO2的反应,根据氧化还原反应配平可得,该学反应方程式为:5NaClO3+6HCl =6ClO2↑+5NaCl+3H2O,反应中转移电子为5e-,若反应中有2mol电子发生转移,则生成ClO2 2.4mol,故答案为:5NaClO3+6HCl =6ClO2↑+5NaCl+3H2O;2.4;
(4)①NaClO是强碱弱酸盐,故ClO-水解使溶液呈碱性,该水解的离子方程式为: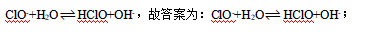
②由于NaClO+2HCl=NaCl+Cl2↑+H2O生成有毒气体Cl2,故调节NaClO溶液pH时不能选用盐酸,故答案为:NaClO+2HCl=NaCl+Cl2↑+H2O产生有毒气体Cl2污染环境;
③由表中数据可推断,等浓度的NaClO溶液pH越大,细菌杀灭率越小,故答案为:等浓度的NaClO溶液pH越大,细菌杀灭率越小;
④由于HClO见光易分解,不易保存,而次氯酸钠性质较稳定则易保存,故家用消毒常用84消毒液而不采用次氯酸,故答案为:HClO见光易分解,不易保存,而次氯酸钠性质较稳定则易保存。
2.(1) KClO3+6HCl=KCl+3Cl2↑+3H2O k→j→d→e 分液漏斗 饱和NaCl溶液 吸收未反应的Cl2,并防止空气中的水蒸气进入装置E
(2)NaH是离子化合物,难溶于有机溶剂,生成的NaCl沉积在反应物表面使反应物难以接触(或其他合理答案)
(3) 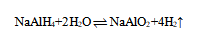 丁
丁
【分析】首先通过C装置A制备氯气,通过装置F除去其中混入的氯化氢后,再通过装置
C干燥氯气,在装置B中和铝发生反应生成氯化铝,最后要注意用碱石灰除去没有反应完的氯气,以此解题。
【详解】(1)①圆底烧瓶中,氯酸钾和稀盐酸反应生成氯化钾、氯气和水,化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O
②制得的氯气先通过F除去HCl,再通过C除去水,再进入B发生反应,故接口顺序为k→j→d→e;
③A中盛放浓硫酸的仪器为分液漏斗;F中盛放饱和食盐水除去HCl,D的作用是吸收未反应的氯气,同时防止空气中的水蒸气进入装置E
(2)NaH是离子化合物,难溶于有机溶剂,生成的氯化钠沉积在反应物表面使反应物难以接触从而使转化率极低。
(3)①铝氢化钠与水反应生成偏铝酸钠和氢气,反应方程式为NaAlH4+2H2O ⇌ NaAlO2+4H2↑
②使用恒压分液漏斗使操作更加简便,利用注射器使装置更加简单且准确性较高,故选择丁。